金属的耐腐蚀性
什么是耐腐蚀?
金属抵抗腐蚀的能力称为耐蚀性。这种能力是由特定条件下的腐蚀速率决定的。定量和定性特征用于评估腐蚀程度。

质量特征是:
-
改变金属表面的外观;
-
金属微观结构的变化。
数量特征是:
-
第一个腐蚀焦点出现之前的时间;
-
在一定时间内形成的腐蚀灶数量;
-
单位时间金属减薄;
-
单位时间内单位面积金属质量的变化;
-
单位时间内单位表面腐蚀吸收或释放的气体体积;
-
给定腐蚀速率下的电流密度;
-
一段时间内属性的变化(机械属性、反射率、电阻)。
不同的金属具有不同的耐腐蚀性。为了提高耐腐蚀性,采用特殊方法:钢合金化、镀铬、镀铝、镀镍、喷漆、镀锌、钝化等。
铁和钢

在氧气和纯水存在下,铁迅速腐蚀,反应按以下公式进行:
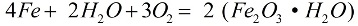
在腐蚀过程中,一层松散的锈层覆盖在金属上,这层锈层根本不能保护它免受进一步破坏,腐蚀会一直持续到金属完全被破坏。更活跃的铁腐蚀是由盐溶液引起的:即使空气中存在少量氯化铵 (NH4Cl),腐蚀过程也会进行得更快。在盐酸(HCl)的稀溶液中,反应也会积极进行。
浓度超过 50% 的硝酸 (HNO3) 会导致金属钝化——它会被一层保护层覆盖,尽管它很脆弱。汽化硝酸对铁是安全的。
浓度高于 70% 的硫酸 (H2SO4) 会使铁钝化,如果 St3 级钢在 40°C 的温度下储存在 90% 的硫酸中,那么在这些条件下,腐蚀速率不会超过每年 140 微米。如果温度为 90°C,则腐蚀将以 10 倍的速度继续进行。铁浓度为50%的硫酸会溶解。
磷酸(H3PO4)不会腐蚀铁,碱性溶液、氨水、干燥的Br2和Cl2等无水有机溶剂也不会。
如果将千分之一的铬酸钠加到水中,它会像六偏磷酸钠一样成为一种极好的铁腐蚀抑制剂。但氯离子 (Cl-) 会去除铁的保护膜并增加腐蚀。铁是技术纯的,含有约 0.16% 的杂质,并且具有很高的耐腐蚀性。
中合金钢和低合金钢
在低合金钢和中合金钢中添加铬、镍或铜合金可提高其耐水和大气腐蚀能力。铬越多,钢的抗氧化性越高。但如果铬含量低于12%,那么化学活性介质就会对这种钢材产生破坏作用。
高合金钢
在高合金钢中,合金成分在10%以上。如果钢中含有 12% 到 18% 的铬,那么这种钢可以承受几乎所有的有机酸、食物、硝酸 (HNO3)、碱和许多盐溶液的接触。在 25% 的甲酸 (CH2O2) 中,高合金钢将以每年约 2 毫米的速度腐蚀。但是,强还原剂、盐酸、氯化物和卤素会破坏高合金钢。
镍含量为 8% 至 11% 和铬含量为 17% 至 19% 的不锈钢比单独使用高铬钢更耐腐蚀。此类钢可耐受酸性氧化介质,例如铬酸或硝酸,以及强碱。
镍作为添加剂将提高钢对非氧化环境和大气因素的抵抗力。但环境是酸性的、还原性的、带有卤素离子的酸性物质——它们会破坏钝化氧化层,结果使钢材失去耐酸能力。
添加1%~4%钼的不锈钢比铬镍钢具有更高的耐蚀性。钼可以抵抗硫酸和硫酸、有机酸、海水和卤化物。
硅铁(添加 13 至 17% 硅的铁),即所谓的铁硅铸件,由于存在 SiO2 氧化膜而具有耐腐蚀性,硫酸、硝酸或铬酸都不能破坏它,他们只是加强了这层保护膜。但是盐酸(HCl)很容易腐蚀硅铁。
镍合金和纯镍

镍可以抵抗许多因素,包括大气和实验室、清洁水和盐水、碱性和中性盐,例如碳酸盐、醋酸盐、氯化物、硝酸盐和硫酸盐。非含氧和非热有机酸以及浓度高达 60% 的沸腾浓碱性氢氧化钾 (KOH) 不会损害镍。
腐蚀是由还原性和氧化性介质、氧化性碱性或酸性盐、氧化性酸(例如氮气、潮湿气态卤素、氮氧化物和二氧化硫)引起的。
蒙乃尔金属(镍含量高达 67%,铜含量高达 38%)比纯镍更耐酸,但不能承受强氧化性酸的作用。它的不同之处在于对有机酸和大量盐溶液具有相当高的抵抗力。大气和水腐蚀不会威胁蒙乃尔金属;氟化物对他来说也是安全的。蒙乃尔金属可以像铂金一样安全地承受 40% 的沸腾氟化氢 (HF)。
铝合金和纯铝

铝的保护性氧化膜使其能够抵抗常见的氧化剂、乙酸、氟、大气以及大量的有机液体。杂质含量低于 0.5% 的工业纯铝非常耐过氧化氢 (H2O2) 的作用。
它在强还原环境中被苛性碱的作用破坏。稀硫酸和发烟硫酸对铝来说并不可怕,但中等强度的硫酸会破坏它,热硝酸也是如此。
盐酸会破坏铝的保护性氧化膜。铝与汞或汞盐接触对前者具有破坏性。
纯铝比硬铝合金(其中铜含量高达 5.5%、镁含量高达 0.5% 和锰含量高达 1%)等更耐腐蚀,而后者的抗腐蚀性较差。 Silumin(添加 11 到 14% 的硅)在这方面更稳定。
铜合金和纯铜

纯铜及其合金在盐水或空气中不腐蚀。铜不怕腐蚀:稀碱、干燥 NH3、中性盐、干燥气体和大多数有机溶剂。
青铜等含有大量铜的合金可以承受酸,甚至是冷浓硫酸或热稀硫酸,或室温(25°C)下的浓盐酸或稀盐酸。
在没有氧气的情况下,铜与有机酸接触不会腐蚀。氟和干燥的氟化氢对铜都没有破坏作用。
但铜合金和纯铜在有氧存在的情况下会被各种酸腐蚀,以及与湿 NH3、某些酸盐、乙炔、CO2、Cl2、SO2 等湿气体接触。铜很容易与汞相互作用。黄铜(锌和铜)的耐腐蚀性不强。
在此处查看更多详细信息 - 电气工程中的铜和铝
纯锌

干净的水,就像干净的空气一样,不会腐蚀锌。但如果水中或空气中有盐类、二氧化碳或氨气,锌就会开始腐蚀。锌溶解在碱中,尤其是在硝酸 (HNO3) 中溶解得更快,在盐酸和硫酸中溶解得更慢。
有机溶剂和石油产品一般对锌没有腐蚀作用,但如果长时间接触,如与裂化汽油接触,汽油在空气中氧化,酸度增加,开始腐蚀锌。
纯铅

铅对水和大气腐蚀的高抵抗力是众所周知的事实。它不会腐蚀 我带领 当在土壤中时。但如果水中含有大量二氧化碳,那么铅会溶解在其中,因为会形成碳酸氢铅,而碳酸氢铅已经是可溶的。
一般来说,铅对中性溶液有很强的抵抗力,对碱性溶液有一定的抵抗力,对某些酸也有抵抗力:硫酸、磷酸、铬酸和硫酸。用浓硫酸(98%以上)在25℃的温度下,铅能慢慢溶解。
浓度为 48% 的氟化氢在加热时会溶解铅。铅与盐酸和硝酸、甲酸和乙酸发生强烈反应。硫酸会在铅上覆盖一层微溶的氯化铅 (PbCl2),并且不会进一步溶解。在浓硝酸中,铅也会镀上一层盐,但稀硝酸会溶解铅。氯化物、碳酸盐和硫酸盐对铅没有侵蚀性,而硝酸盐溶液则相反。
纯钛

良好的耐腐蚀性是钛的标志。不被强氧化剂氧化,耐盐溶液、FeCl3等。浓无机酸会引起腐蚀,但即使沸腾的硝酸浓度低于 65%,硫酸 - 高达 5%,盐酸 - 高达 5% - 也不会导致钛腐蚀。对碱、碱性盐和有机酸的正常耐腐蚀性将钛与其他金属区分开来。
纯锆

锆比钛更能抵抗硫酸和盐酸,但对王水和湿氯的抵抗力较差。它对大多数碱和酸具有高耐化学性,耐过氧化氢 (H2O2)。
某些氯化物、沸腾的浓盐酸、王水(浓硝酸 HNO3 (65-68 wt.%) 和盐水 HCl (32-35 wt.%) 的混合物、热浓硫酸和发烟硝酸的作用关于腐蚀,这是锆的疏水性等特性,即这种金属不会被水或水溶液润湿。
纯钽

钽优异的耐化学性与玻璃相似。其致密的氧化膜可在高达 150°C 的温度下保护金属免受氯、溴、碘的作用。正常条件下大多数酸对钽不起作用,即使是王水和浓硝酸也不会引起腐蚀。碱溶液对钽几乎没有影响,但氟化氢对其有作用,使用浓热碱溶液,碱熔体用于溶解钽。
