法拉第电解定律
法拉第电解定律是基于迈克尔·法拉第 (Michael Faraday) 于 1836 年发表的电化学研究的定量关系。
这些定律决定了物质释放量之间的关系 电解过程中 以及通过电解液的电量。法拉第定律有两个。在科学文献和教科书中,这些定律有不同的表述。
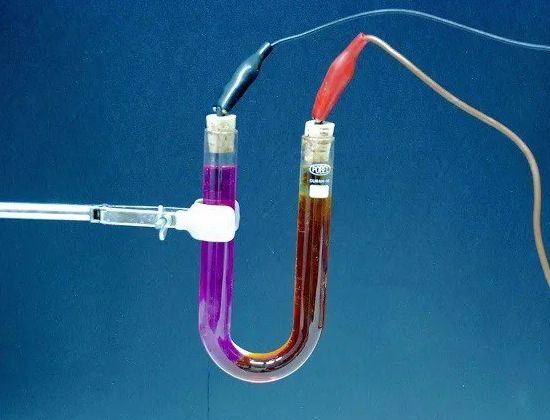
电解 — 在通过过程中从电解质中释放出其组成物质 电……例如,当电流通过微酸化的水时,水会分解成它的组成部分——气体(氧气和氢气)。
从电解液中释放出的物质的量与通过电解液的电量成正比,即电流强度乘以该电流流过的时间的乘积。因此,电解现象可以用来衡量电流的强弱,从而判断 当前单位.
电解液 — 一种溶液,通常是一种传导电流的复杂液体。在电池中,电解质是硫酸溶液(铅溶液)或苛性钾或烧碱溶液(铁镍溶液)。在原电池中,任何化合物(氨、硫酸铜等)的溶液也可用作电解质。
迈克尔·法拉第 (1791 - 1867)
迈克尔·法拉第 (1791—1867)——英国物理学家,现代电磁现象学说的奠基人。他的职业生涯始于一家装订车间的学徒。他只接受过初等教育,但独立学习科学并担任化学家德维的实验室助理,他成为了一位伟大的科学家,最伟大的实验物理学家之一。
法拉第开了 电磁感应现象,电解定律,发展了电场和磁场学说并奠定了基础 现代电磁场概念的基础……他是第一个提出电磁现象的振动、波动性质想法的科学家。
法拉第电解第一定律
电解过程中沉淀在电极上的物质的质量与转移到该电极(通过电解液)的电量成正比。电量是指电荷的多少,通常以挂件来衡量。
法拉第电解第二定律
对于给定量的电量(电荷),电解过程中沉积在电极上的化学元素的质量与该元素的等效质量成正比。物质的当量质量是其摩尔质量除以一个整数,具体取决于该物质所参与的化学反应。
或者
相同的电量导致电解过程中电极上释放出等量的不同物质。放出一摩尔当量的任何物质,都需要消耗等量的电量,即96485℃。这个电化学常数称为 法拉第数.
法拉第定律的数学形式
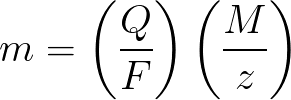
-
m 是沉积在电极上的物质的质量;
-
Q 是在电解过程中通过的吊坠中的总电荷值;
-
F = 96485.33 (83) C/mol — 法拉第数;
-
M 是元素的摩尔质量,单位为 g/mol;
-
z——物质离子的价数(每个离子的电子数);
-
M/z——施加在电极上的物质的当量质量。
应用到法拉第电解第一定律,M、F、z都是常数,所以Q越大,m就越大。
根据法拉第电解第二定律,Q、F、z是常数,所以M/z越大,m也越大。
对于直流电,我们有
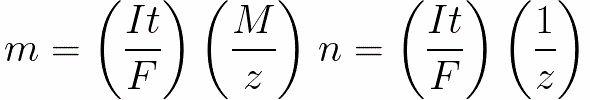
-
n是释放在电极上的摩尔数(物质的量):n=m/M。
-
t是直流电流通过电解质的时间。对于交流电,总电荷会随时间累积。
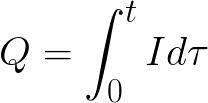
-
t 是总电解时间。
应用法拉第定律的示例
需要写出惰性阳极电解硫酸钠水溶液时阴极和阳极的电化学过程方程式。问题的解决方案如下。在溶液中,硫酸钠将根据以下方案解离:
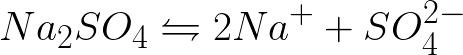
该体系中的标准电极电位如下:
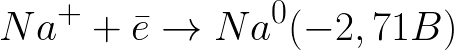
这比中性介质中的氢电极 (-0.41 V) 负得多。因此,在负电极(阴极)上,水的电化学解离将根据以下方案开始释放氢和氢氧根离子:
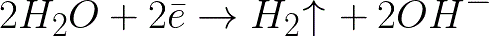
并且接近带负电的阴极的带正电的钠离子将在阴极附近,在溶液的相邻部分中积累。
根据以下方案,水会在正极(阳极)发生电化学氧化,从而导致氧气的释放:
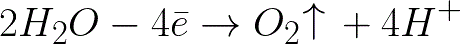
在此系统中,标准电极电位为 +1.23 V,远低于以下系统中的标准电极电位:
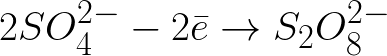
向带正电的阳极移动的带负电的硫酸根离子将聚集在靠近阳极的空间中。

